1前言
铝材阳极氧化和着色属化工过程,它涉及到使用各种化工原料,而排放的废液中则含有大量的化学物质,这些物质主要来源于常温脱脂、碱蚀、出光、阳极氧化、着色和封孔等工序,在每道工序之后,都要经过充分的冲洗,将附着在铝型材上的药液洗净,这些洗涤水中有些是碱性的,有些是酸性的。因此,在排放含酸性和碱性的废水中,通过中和反应,在一定的pH范围内,不少阳离子如Al3+、Sn2+、Mg2+、Ni2+等生成氢氧化物沉淀:
2NaAlO2+ H2SO4+ 2H2O → Na2SO4+ 2Al(OH)3
2NaOH+ H2SO4 → Na2SO4+ 2H2O
NiSO4+ 2NaOH → Ni(OH)2+Na2SO4
MgSO4+ 2NaOH → Mg(OH)2+Na2SO4
SnSO4+ 2NaOH → Sn(OH)2+Na2SO4
Fe2(SO4)3+ 6NaOH → 3Na2SO4+ 2Fe(OH)3
Al2(SO4)3+6NaOH → 3Na2SO4+ 2Al(OH) 3
经中和后,反应生成物中的沉淀物有Al(OH)3、Ni(OH)2、S(OH)2、Mg(OH)2和Fe(OH)3;溶液中则有Na2SO4,其中Al(OH)3和Na2SO4是主要的。因此,要从废液中回收硫酸铝是完全可能的。
在铝材生产的常温脱脂、碱蚀、出光、阳极氧化、着色和封孔等工序中,碱蚀是消耗铝最多的工序,其目的是使铝材的表面均匀而得到较好地表面,因而铝材受到较大的腐蚀和损耗,一般碱蚀损耗的铝材为0.6%~0.9%,按年产10000吨铝材的工厂计算,年耗铝为60~90吨。此外,铝阳极氧化以硫酸作电解液,在电解过程中,铝发生化学溶解生成Al3+,致使铝材进一步损耗,并排放出大量的废硫酸。
针对铝材生产中的这些情况,我们对废液中的硫酸铝进行了回收试验研究,探讨了回收工艺流程。为更好地回收硫酸铝提供了实验依据。
2实验
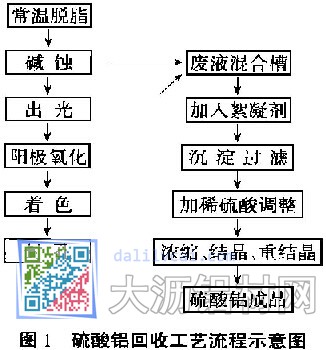
2.1回收工艺流程
2.2离子分析
由于硫酸铝的回收主要来自于碱蚀和铝阳极氧化工序,因此溶液中离子的分析针对这两个工序进行。
2.2.1碱蚀槽液中总碱、铝、游离碱的测定
在酒石酸钾钠过量下,用盐酸滴定总碱,然后加入氟化钾,氢氧化铝与氟离子结合放出氢氧根离子,再用盐酸滴定这些氢氧根离子,可计算出铝离子的量,具体反应为:
NaOH+ HCl → NaCl+ H2O
Al(OH)4-+H++4(C4H4O6)42- → [Al(OH)3(C4H4O6)4]8-+H2O
[Al(OH)3(C4H4O6)4]8-+6F- → AlF63-+ 3OH-+4(C4H4O6)42-
3OH-+3H+ → 3H2O
实验步骤为:准确吸取碱蚀液5.00 mL于250mL锥形瓶中,加入30mL酒石酸钾钠溶液和50mL蒸馏水,加入2滴酚酞指示剂,用盐酸标准溶液(浓度为CHCl滴定至红色消失为终点,记下滴定读数为V1;然后加入20mL氟化钾溶液(此时溶液再显红色),继续用盐酸标准溶液(浓度为CHCl)滴定至红色消失为终点,记下滴定读数为V2。计算:
总碱 ω (NaOH)=40 CHClV1/5.00(g/L)
铝 ω (Al)=27CHClV2/(3×5.00)(g/L)
游离碱 ω (NaOH)=40 CHClV1(V1-V2)/5.00(g/L)
2.2.2 铝阳极氧化溶液中总硫酸、铝、游离硫酸的测定
(1)总硫酸的测定:准确吸取试液5.00mL于250 mL锥形瓶中,加入100 mL蒸馏水,3~5滴酚酞指示剂,用氢氧化钠标准溶液(浓度为CNaOH)滴定至淡红色为终点,记下滴定读数为V1。
总硫酸 ω (H2SO4)=49 CNaOHV1/5.00(g/L)
(2)游离硫酸的测定:准确吸取试液5.00m于250mL锥形瓶中,加入100 mL蒸馏水,0.3~0.5 g氟化钾,3~5滴酚酞指示剂,用氢氧化钠标准溶液(浓度为CNaOH滴定至淡红色为终点,记下滴定读数为V2。
游离硫酸 ω (H2SO4)=49 CNaOHV2/5.00(g/L)
(3)游离硫酸及铝的连续测定:准确吸取试液5. 00 mL于250 mL锥形瓶中,加入50mL蒸馏水,加甲基橙2滴,用氢氧化钠标准溶液(浓度为CNaOH)滴定至由红变为橙色为终点V1;然后再加入3~5滴酚酞指示剂,以氢氧化钠标准溶液(浓度为CNaOH)滴定至淡红色不退为终点(V2)。
游离硫酸 ω (H2SO4)=49CNaOH V1/5.00(g/L)
铝 ω (Al)=27CNaOHV2/(3×5.00) (g/L)
2.2.3硫酸铝中Al3+和SO42-的测定
(1) Al3+的测定:采用EDTA络合滴定法,其原理为:在弱酸性溶液(加入pH5.0~6.0的缓冲溶液)中,铝离子与过量的EDTA络合,用氯化锌标准溶液滴定过量的EDTA。然后加入过量的氟化钠,F-与络合的铝离子反应,置换出与铝离子络合的EDTA,再用氯化锌标准溶液滴定EDTA,从而计算铝离子的含量。
(2)SO42-的测定:采用重量分析法,加入过量的BaCl2,使硫酸根完全以BaSO4沉淀,经洗涤、灼烧等处理,通过称量BaSO4的量来计算SO42-的含量。
2.3溶液pH值的测定
所有溶液的pH值均在室温条件下,采用320型pH计(上海Mettler-TOLEDO有限公司生产)进行测定。
3讨论
根据铝合金阳极氧化生产工艺(如图1),对生产中的碱蚀和阳极氧化槽内的溶液进行了分析。碱蚀溶液的铝离子高达120~130 g/L,NaOH则维持在40~60 g/L之间。由于碱蚀槽内加入由多种物质组成的添加剂,致使溶液中NaAlO的含量达350~400g/L,所以碱蚀溶液的碱性很强,铝离子的含量非常高。而铝阳极氧化槽内溶液的成分为:H2SO4 170 g/L左右,Al3+ 16~21 g/L。当碱蚀废液和阳极氧化废液排放时,由于排放量的比例不同,混合溶液的pH也不一样,但总体而言,混合后偏碱性。
针对上述实验结果,我们在硫酸铝回收工艺流程中,根据铝的两性,在pH为4.0时开始沉淀,pH为5.5时完全沉淀,而在pH为7.8时沉淀开始溶解,pH为10.8时沉淀完全溶解。因此,排放碱蚀废液和阳极氧化废液时,最好控制pH在5.5左右,使混合槽内的酸碱物质发生反应生成Al(OH)3沉淀,再加入一定量的高分子凝聚剂以便加快沉淀速度,然后采用压缩空气搅拌4~6 min,混合均匀后,静置4~6h。过滤得到以Al(OH)3为主要成分的沉淀物,再用稀硫酸溶液调整pH为2,将上层清液转移到反应锅内,加热浓缩至结晶析出,得硫酸铝结晶粗品。由于此结晶含杂质较多,必须进行2~4次重结晶,这样可得到纯度高达99. 6%的硫酸铝。
按照我们所试验的硫酸铝回收工艺(图1),年产铝材10000吨的工厂,一年可生产硫酸铝约为1500吨,具有较好的经济效益。
经过多次试验,该硫酸铝回收工艺流程比工业制硫酸铝简单,处理方便,并可与废水处理结合起来,解决了铝材生产环保问题。
4结论
将铝合金阳极氧化生产中碱蚀和阳极氧化工序的废液按一定的比例排放至混合槽内,控制混合液的pH值为5.5左右,通过加入凝聚剂、沉淀过滤、稀硫酸调整pH值、加热浓缩结晶、重结晶等工序可得到高纯度的硫酸铝。该回收处理操作简便,既解决了环保问题,又提高了经济效益。
根据铝合金阳极氧化生产工艺,由碱蚀和阳极氧化两道工序排放的含有大量铝离子的酸碱溶液,按一定量的比例混合,控制混合液的pH在5.5左右,再采用加入凝聚剂、沉淀过滤、稀硫酸调整pH、加热浓缩结晶、重结晶等一系列工艺可得到高纯度的硫酸铝。该工艺流程简单、方便可行。既可解决铝材生产的环保问题,又可得到较好的经济效益。




